Dank seiner einzigartigen Plattform zur Antikörper-KD-Bestimmung ist ProteoGenix DIE Referenz in der Antikörper-Affinitätsmessung. Dank unserer drei Technologien ist nun die Messung der Wechselwirkungen mit Zellen, Bakterien und Proteinen in nativer Konformation sowie die Hochdurchsatz-KD-Bestimmung möglich. Teilen Sie uns Ihre Anforderungen mit, und unsere promovierten Account Manager werden die beste Lösung für Ihre Genauigkeits-, Preis- und Terminerwartungen bestimmen.
Warum sollten Sie ProteoGenix für Ihr
Antikörper KD Bestimmung?

wettbewerbsfähiger Preis
Wir garantieren den günstigsten Preis am Markt.

3 verschiedene, sich ergänzende Technologien
Messung der Antikörperaffinität mittels SPR, SPRi oder Octet

Einzigartiger Service zur Messung der Antikörper-Zellen-Affinität
Auch kompatibel mit Hochdurchsatz-KD-Bestimmung

Modernste Ausrüstung
Wir gehören zu den wenigen Dienstleistern, die Antikörper-KD-Bestimmung mittels SPRi anbieten.

Labelfreie Messung
Keine zusätzliche Bearbeitungszeit, keine Extrakosten, keine Artefakte oder Verzerrungen (okkludierte Bindungsstelle, falsche hydrophobe Wechselwirkung)

Promovierte Account Manager
Sie benötigen Beratung bei der Wahl der am besten geeigneten Technologie? Unsere wissenschaftlichen Account Manager unterstützen Sie bei der Entscheidung.

Schnelle Abwicklung
Sie erhalten die KD-Werte Ihres Antikörpers nach nur 2 bis 3 Wochen.
Auf Ihre Anforderungen zugeschnittener Service zur Messung der Antikörperaffinität
ProteoGenix hat bereits mehr als 300 monoklonale Antikörper für verschiedene Kunden entwickelt und charakterisiert und verfügt somit über starke Expertise in der molekularbiologischen Wechselwirkungsanalyse. Ganz gleich, ob Sie für Ihr Projekt eine Hochdurchsatz-KD-Bestimmung oder eine Rohprobenanalyse (Zellen, Bakterien, …) benötigen, finden Sie bei uns die passende Lösung für Ihre Anforderung.
 SPR / GE Biacore X100 – T200 – 8K
|
 SPRi / Horiba XelPlex
|
 Octet / ForteBio Octet Red
|
|
|---|---|---|---|
| Anwendung | „Goldstandard“- Hochdurchsatz-KD-Bestimmung Antikörper-Antigen-Wechselwirkung Molekularbiologische Wechselwirkungsanalyse |
Hochdurchsatz-KD-Bestimmung Antikörper-Zellen-Wechselwirkungsanalyse Molekularbiologische Wechselwirkungsanalyse |
Hochdurchsatz-KD-Bestimmung Molekularbiologische Wechselwirkungsanalyse |
| Technologie | Oberflächenplasmonresonanz (SPR) | Oberflächenplasmonresonanz-Imaging (SPRi) | Interferometrie |
| Messprinzip | Brechungsindexänderung | Brechungsindexänderung | Wellenlängenverschiebung |
| Labelfrei | Ja | ||
| Rohprobenanalyse (Zellen, Bakterien, …) | Nein | Ja | Ja |
| Möglichkeit des Coatings von Proteinen (außer Antikörpern) unter Beibehaltung der nativen Konformation | Nein | Ja | Nein |
| Bildgebung | Nein | Ja | Nein |
| Multiplexing | ++ | ++++ | ++ |
| Nachweisgrenze | +++ | +++ | + |
| Technische Komplexität | + | +++ | ++ |
| Kosten/Antikörper | + | +++ | ++ |
| Lieferzeit | 2–3 Wochen | ||
Sie sind unschlüssig, welches Antikörper- KD -Bestimmungsverfahren für Ihre Studie am besten geeignet ist?
Teilen Sie Ihre Anforderungen unserem promovierten Account Manager mit.
Fallstudie 1: Antikörper-KD-Bestimmung zwischen einem Anti-Protein-X-Antikörper und an der Oberfläche von 293T-Zellen exprimiertem Protein X mittels SPRi (Horiba XelPlex)
UNTERSUCHUNGSZIEL
Wir wurden von einem Kunden beauftragt, die Protein-X-Antikörper-Bindungsaffinität für ein an der Oberfläche von 293T-Zellen exprimiertes Transmembranprotein X zu messen. Durch die Expression und Präsentation des Proteins direkt in der Zelle konnten wir das extrazelluläre Epitop unter Erhalt seiner nativen Konformation präsentieren.
Die Messungen erfolgten mittels Oberflächenplasmonresonanz-Imaging (Horiba XelPlex).
BIOCHIP-FUNKTIONALISIERUNG
Der Biochip wurde unter Anwendung einer klassischen Aminkopplungsstrategie modifiziert: Eine –COOH-terminierte Oberfläche wurde mittels EDC/NHS aktiviert, sodass ein reaktionsfähiger Sulfo-NHS-Ester entstand. Von diesem Zwischenprodukt ist bekannt, dass es mit primärem Amin zu einer stabilen Amidbrücke reagiert.
Zwei Verfahren zur Deposition des Anti-Protein-X-Antikörpers wurden weiter getestet, um den optimalen Spotting-Ansatz zu bestimmen (nähere Informationen sind der PDF-Datei zu entnehmen).
UNTERSUCHUNG DER SPEZIFITÄT DER ANTIKÖRPER-ANTIGEN-WECHSELWIRKUNG
Die Protein-X-Zellen-spezifische Bindung wurde anhand des Vergleichs von Kinetikkurven untersucht, die durch Injektion von Protein-X-Zellen und Kontrollzellen (durch leeres Plasmid transfizierte 293T-Zellen) auf einen mit Anti-Protein-X-Antikörper modifizierten Biochip bestimmt worden waren.
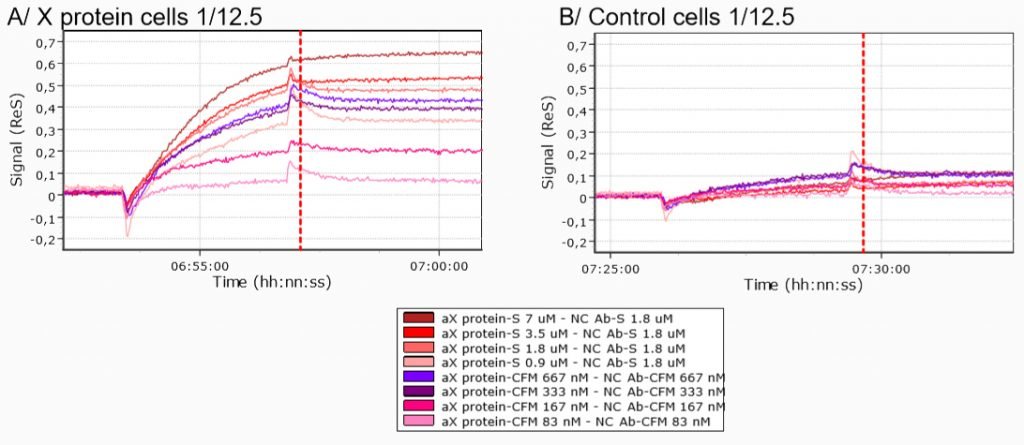
Der Vergleich der Protein-X-Zellen- und Kontrollzellen-Injektionen auf dem mit Anti-Protein-X-Antikörper modifizierten Biochip ergab einen klaren Unterschied der Kinetikkurven unabhängig von den Immobilisierungsbedingungen.
Somit belegen die ermittelten Daten eine spezifische Bindung von Protein-X-Zellen an den Anti-Protein-X-Antikörper.
KINETISCHE UND THERMODYNAMISCHE ANALYSE DER ANTIKÖRPER-ZELLEN-WECHSELWIRKUNG
Durch Injektion verschiedener Konzentrationen von Protein-X-Zellen auf die mit dem Anti-Protein-X-Antikörper modifizierte Oberfläche wurden Kinetikkurven bestimmt. Als Depositionsverfahren wurde dasjenige gewählt, das in der ersten oben genannten Untersuchung die besten Ergebnisse lieferte.
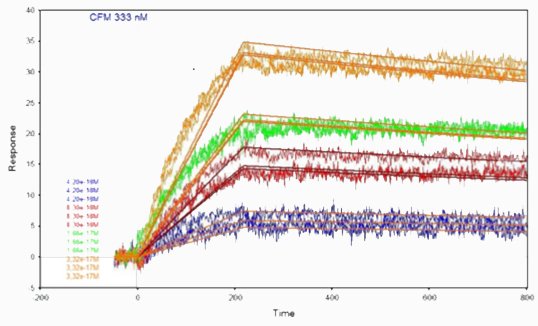
Die kinetischen Parameter wurde durch Anpassung der Kurven bei verschiedenen Konzentrationen anhand eines 1:1-Wechselwirkungsmodells bestimmt. Der Antikörper-KD -Wert wurde durch Berechnung des kd/ka -Verhältnisses ermittelt.
| Kinetische und thermodynamische Parameter | |||
|---|---|---|---|
| ka(M-1.s-1) | kd (s-1) | KD (M) | |
| Anti-Protein-X / Protein-X-Zellen | 1.00.1010 | 2,46×10-4 | 2,46×10-14 |
SCHLUSSFOLGERUNG
Die spezifische von Protein-X-Zellen an den Anti-Protein-X-Antikörper wurde mittels SPRi nachgewiesen.
Die SPRi-Signale ermöglichten die Messung einer niedrigen anscheinenden KD, was als hochaffine Antikörper-Zellen-Wechselwirkung interpretiert werden kann. Diese Bindungsaffinität wird hauptsächlich durch eine hohe Assoziationsrate (ka) gesteuert. Die Multiplexing-Konfiguration der SPRi gestattete die Immobilisierung des Anti-Protein-X-Antikörpers auf demselben Biochip mit den beiden unterschiedlichen Immobilisierungsmethoden und in vier Konzentrationen je Immobilisierungsmethode. Bei diesem Versuch wurden auf einem einzigen Biochip 8 verschiedene Versuchsbedingungen getestet und 282 verschiedene Sensorgramme generiert.
Fallstudie 2: Antikörper-KD-Untersuchung mittels Biacore-Analyse
UNTERSUCHUNGSZIEL
Wir erhielten von einem Kunden den Auftrag, die KD einer Antikörper-Antigen-Wechselwirkung mittels Biacore zu messen. In dem Projekt ging es um das Affinitätsranking 5 verschiedener Antikörper gegen dasselbe Antigen.
VERSUCHSAUFBAU
Das Antigen wurde auf der mit Dextran beschichteten Biochip-Oberfläche mithilfe klassischer Maleimidchemie, die in einer stabilen, kovalenten Thioetherbindung resultiert, immobilisiert. Anschließend wurden Lösungen mit dem Antikörper in verschiedenen Konzentrationen über das Antigen gegeben. Die Messung des SPR-Signals bei den verschiedenen Antikörperkonzentrationen ermöglichte die Bestimmung der kinematischen Parameter (On-Rate ka, Off-Rate kd) und thermodynamischen Parameter (KD) selektiert werden.
ANTIKÖRPER-AFFINITÄTSMESSUNG
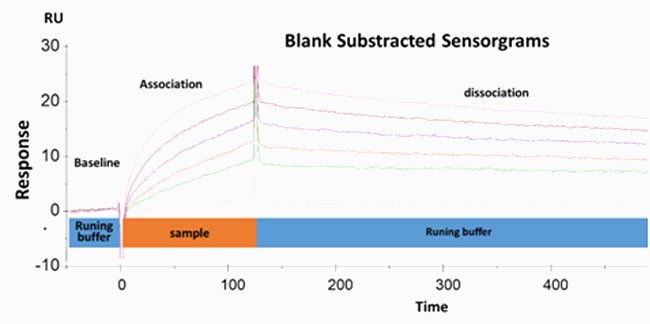
Die Antikörper-Antigen-Bindungsaffinität kann aus dem kd/ka -Verhältnis abgeleitet werden, sodass es möglich ist, ein Affinitätsranking aufzustellen.
| Antikörper | ka (1/Ms) | kd (1/s) | KD (M) |
|---|---|---|---|
| A | 4,30×104 | 2,24×10-4 | 5,21×10-9 |
| B | 1,26×105 | 9,08×10-4 | 7,23×10-9 |
| C | 6,71×105 | 3,85×10-4 | 5,73×10-10 |
| D | 2,53×105 | 4,03×10-4 | 1,59×10-9 |
| E | 2,36×105 | 7,97×10-4 | 3,72×10-9 |
Das Antikörperaffinitätsranking lässt sich direkt aus dem Antikörper-KD -Wert ableiten, da ein niedrigerer KD -Wert eine höhere Affinität des Antikörpers bedeutet
Antikörper-KD -Ranking: C<D<E<A<B
Antikörperaffinitätsranking: C>D>E>A>B
SCHLUSSFOLGERUNG
Die Biocore-Analyse ermöglichte den Schluss, dass alle 5 getesteten Antikörper eine hohe Affinität für das Antigen aufweisen, wobei C aus mehreren Gründen den besten Antikörper darstellt:
- niedriger KD -Wert, der eine starke Wechselwirkung anzeigt
- günstige kinetische Parameter (hohe Assoziationsrate und niedrige Dissoziationsrate)
