Nous comprenons que l'humanisation des anticorps est l'une des étapes les plus critiques sur la voie de l'IND. C'est pourquoi nos experts comptent parmi les scientifiques les plus renommés au monde dans ce domaine et peuvent se targuer d'un palmarès impressionnant. Nous avons actuellement 3 anticorps thérapeutiques déjà sur le marché et plus de 30 en phase préclinique et clinique. Nous considérons chaque nouvelle humanisation d'anticorps monoclonal comme un défi unique et passionnant pour amener votre composé en clinique.
Pourquoi choisir ProteoGenix pour votre humanisation
d'anticorps monoclonal ?

Des experts reconnus en humanisation d'anticorps
Accédez à des experts ayant plus de 25 ans d’expérience et un palmarès inégalé en matière d’humanisation d’anticorps.

Modélisation 3D
Notre plateforme de modélisation moléculaire 3D garantit la conservation des fonctions biologiques.

Libre de droit
Vous obtenez la pleine propriété des anticorps humanisés.

Ensemble complet de services de caractérisation
ELISA, détermination de la KDcontre un antigène soluble ou des cellules, thermostabilité, taux d’agrégation, IC50…

XtenCHOTM
Profitez du système d’expression transitoire le plus productif pour produire toutes vos variantes d’anticorps monoclonaux humanisés !

Diversité de format
Nous optimisons la séquence ou l’humanisation de toutes sortes de formats d’anticorps : IgG pleine longueur, scFv, Fab, VHH (nanocorps)…
Notre processus d'humanisation des anticorps monoclonaux

- Séquençage d’anticorps à partir d’une lignée cellulaire d’hybridome
– Extraction d’ARN et purification
– Transcription reverse
– Amplification par PCR
– Séquençage

- Évaluation de la bioactivité des anticorps chimériques
– Synthèse des gènes, y compris l’optimisation des codons
– Sous-clonage dans un vecteur d’expression
– Production et purification d’anticorps chimériques
– Analyse CQ
Go/No Go 1

- Conception d’un anticorps monoclonal humanisé
– Identification des mutations arrière par modélisation moléculaire 3D
– Sélection des lignées germinales humaines les plus pertinentes
– Greffage de CDR in silico et optimisation de la séquence
Go/No Go 2

- Production d’anticorps humanisés (9 à 18 variantes)
– Synthèse des gènes, y compris l’optimisation des codons
– Sous-clonage dans un vecteur d’expression
– Transfection transitoire, expression et purification
– Analyse CQ
Go/No Go 3

- Caractérisation des variants humanisés
– ELISA contre l’antigène
– Affinité de l’anticorps contre un antigène soluble ou une cellule
– Taux d’agrégation
– Thermostabilité
– Profil de Glycosylation
– Détection d’endotoxine
Le contenu de notre service d'humanisation d'anticorps monoclonal
| Etape | Contenu | Délai | Livrables |
|---|---|---|---|
| Séquençage des anticorps parentaux à partir d’un hybridome |
|
~2-3 semaines |
|
| Expression et purification d’anticorps chimérique |
|
~7-9 semaines |
|
| Design de l’anticorps humanisé |
|
~2 semaines |
|
| Production recombinante transitoire de 9 à 18 variantes d’anticorps humanisés |
|
~7-9 semaines |
|
| Caractérisation de variants d’anticorps humanisés monoclonaux |
|
à déterminer |
|
|
Options disponibles :
|
|||
Quels facteurs doivent être pris en compte dans l'humanisation des anticorps monoclonaux ?
L’objectif principal du processus d’humanisation des anticorps est de développer une séquence d’anticorps conforme aux directives de l’Organisation mondiale de la santé (OMS) pour les anticorps humanisés. En principe, un anticorps est considéré comme humanisé lorsque l’identité de séquence entre l’anticorps et une séquence germinale humaine (de la base de données IMGT) est d’au moins 85 %.
La différence entre un anticorps humanisé et un anticorps entièrement humain dépend de l’origine de l’anticorps ; les anticorps provenant d’espèces non humaines seront classés comme humanisés après humanisation, tandis que les séquences dérivées de l’homme seront considérées comme des « anticorps entièrement humains ».
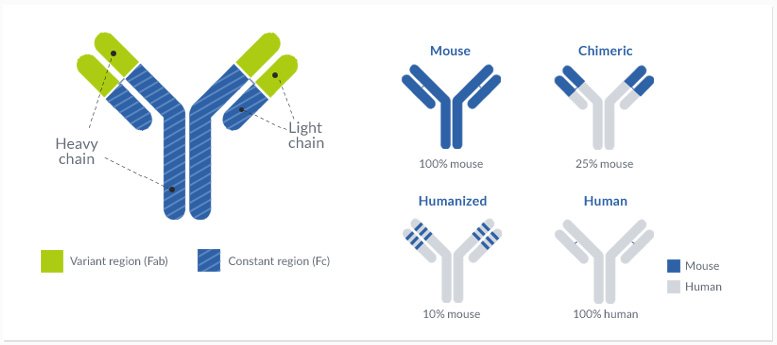
Pour atteindre cet objectif de 85 %, il faut modifier la séquence de l’anticorps dans les régions variables. Ainsi, ce travail d’ingénierie des anticorps peut avoir un impact critique sur les propriétés physicochimiques et pharmacologiques du produit final et doit être réalisé avec soin. Pour cette raison, ProteoGenix combine un savoir-faire inégalé dans l’ingénierie des anticorps avec des experts possédant plus de 25 ans d’expérience et d’un de solides antécédents en matière d’humanisation des anticorps. Notre processus d’humanisation englobe la greffe de CDR, la modélisation moléculaire et l’optimisation de la séquence.
La modélisation moléculaire est une partie importante de ce processus car elle permet d’analyser les contributions des acides aminés individuels localisés dans les boucles CDR murines et dans les régions cadres. Cette étape est essentielle pour identifier les résidus pouvant faire l’objet de mutations rétroactives et ceux qui peuvent être mutés pour une plus grandeoptimisation des propriétés. Les acides aminés impliqués dans les régions variables peuvent être classés comme suit :
-
Résidus impliqués dans l’interaction anticorps-antigène,
-
Les résidus jouant un rôle structurel, par exemple en maintenant la conformation de la boucle de la CDR ou en stabilisant le VH-VL l’interaction,
-
Résidus interagissant avec le solvant.
Résidus des régions cadres murines considérés comme essentiels pour maintenir la conformation des boucles CDR et la bioactivité de l’anticorps,qui seront mutés en retour dans les lignées germinales humaines sélectionnées.
La sélection de la lignée germinale humaine est basée sur l’homologie de séquence, mais d’autres variantes d’humanisation, présentant une homologie de séquence plus faible mais présentant de bonnes propriétés physico-chimiques, peuvent être testées. Dans un projet d’humanisation, ProteoGenix sélectionne plusieurs chaînes lourdes et chaînes légères afin de générer entre Combinaisons 9 et 18.
Les différents anticorps générés sont ensuite caractérisés et comparés à l’anticorps parental et/ou chimérique de référence afin d’évaluer leur efficacité :
-
Immunogénicité
-
Propriété physico chimiques (stabilité, taux d’aggrégation…),
-
Propriétés pharmacologiques (affinité, specificité…),
-
Possibilité de fabrication.
Après des tests réussis, les candidats principaux peuvent être sélectionnés pour une humanisation plus poussée et/ou une optimisation de la séquence des CDRs pour amélioration des propriétés biophysiques (hétérogénéité, fragmentation, agrégation…) et la fabricabilité (bioproduction).
Des services complets de maturation d’anticorps par affinité peuvent être réalisés par phage display à l’aide de banques personnalisées générées par mutagenèse aléatoire ou ciblée.





