Grâce à sa plate-forme unique de détermination du KD des anticorps, ProteoGenix est LA référence pour la mesure de l’affinité des anticorps. La mesure des interactions des anticorps avec les cellules, les bactéries et les protéines en conformation native ou la détermination à haut débit du KD sont désormais possibles grâce à nos trois technologies. Faites-nous part de vos besoins et nos spécialistes détermineront la meilleure solution pour répondre à toutes vos attentes : précision, prix et délai.
Pourquoi choisir ProteoGenix pour
la détermination du KD de vos anticorps ?

Prix ultra-compétitif
Nous vous garantissons les prix les plus bas sur le marché.

3 technologies différentes complémentaires
Mesure de l’affinité des anticorps par SPR, SPRi ou Octet.

Un service unique de mesure de l’affinité de l’interaction anticorps-cellule
Également compatible avec la détermination du KD à haut débit.

Équipements de pointe
Nous sommes l’un des seuls prestataires de services à proposer la détermination du KD des anticorps par SPRi.

Mesure sans marqueur
Aucun délai supplémentaire, aucun frais supplémentaire, aucun artefact ou biais (site de liaison obstrué, fausse interaction hydrophobe).

Des chargés d’affaires titulaires d’un doctorat
Besoin d’un conseil pour sélectionner la bonne technologie ? Tous nos chargés d’affaires sont titulaires d’un doctorat et sauront toujours vous aider à choisir la meilleure solution.

Résultat rapide
Comptez seulement 2 à 3 semaines pour avoir le résultat de vos mesures de KD.
Un service de mesure de l’affinité des anticorps adapté à vos besoins.
Avec déjà plus de 300 anticorps monoclonaux développés et caractérisés pour divers clients, ProteoGenix a acquis une solide expertise en analyse des interactions biomoléculaires. Que votre projet implique la détermination à haut débit de KD ou l’analyse d’échantillons bruts (cellules, bactéries…), nous maîtrisons toutes les technologies nécessaires pour vous apporter la solution la plus appropriée à vos besoins.
|
|
 SPR / GE Biacore X100 – T200 – 8K
|
 SPRi / Horiba XelPlex
|
 Octet / ForteBio Octet Red
|
|---|---|---|---|
| Application | « Étalon or » Détermination à haut débit du KD Interaction anticorps-antigène Analyse des interactions biomoléculaires |
Détermination à haut débit du KD Analyse des interactions anticorps-cellule Analyse des interactions biomoléculaires |
Détermination à haut débit du KD Analyse des interactions biomoléculaires |
| Technologie | Résonance plasmonique de surface (SPR) | Imagerie par résonance plasmonique de surface (SPRi) | Interférométrie |
| Principe de mesure | Variation de l’indice de réfraction | Variation de l’indice de réfraction | Décalage de longueur d’onde |
| Sans marqueur | Oui | ||
| Analyse d’échantillons bruts (cellules, bactérie…) | Non | Oui | Oui |
| Possibilité d’appliquer un revêtement de protéines (autres que des anticorps) tout en conservant leur conformation native | Non | Oui | Non |
| Imagerie | Non | Oui | Non |
| Multiplexage | ++ | ++++ | ++ |
| Limite de détection | +++ | +++ | + |
| Complexité de la technologie | + | +++ | ++ |
| Coût/anticorps | + | +++ | ++ |
| Délai de production | 2/3 semaines | ||
Vous ne savez pas trop quelle technique de détermination du KD d’un anticorps vous devez utiliser pour votre étude ?
Demandez conseil à nos experts.
Étude de cas 1 : Détermination du KD de l’interaction entre un anticorps anti-protéine X et la protéine X exprimée à la surface de cellules 293T par la technologie SPRi (Horiba XelPlex)
OBJECTIF DE L’ÉTUDE
Un client nous a demandé de mesurer l’affinité de la liaison d’un anticorps anti-protéine X à la protéine X transmembranaire exprimée à la surface de cellules 293T. L’expression et l’exposition de la protéine directement à la surface des cellules ont permis l’exposition de l’épitope extra-cellulaire dans sa conformation native.
Les mesures ont été réalisées à l’aide de la technologie d’imagerie par résonance plasmonique de surface (Horiba XelPlex).
Measurements were performed using Surface Plasmon Resonance Imaging technology (Horiba XelPlex).
FONCTIONNALISATION DE LA BIOPUCE
La biopuce a été modifiée à l’aide d’une stratégie de couplage amine classique. En bref, la surface à terminaisons –COOH a été activée par un mélange EDC/NHS pour former des esters sulfo-NHS. Ces intermédiaires réagissent avec les amines primaires pour former des liaisons amides stables.
Deux méthodes de dépôt des anticorps anti-protéine X ont ensuite été testées afin de déterminer la meilleure approche (voir le fichier PDF pour la procédure détaillée).
ÉTUDE DE LA SPÉCIFICITÉ DE L’INTERACTION ANTICORPS-CELLULE
La liaison spécifique des cellules exprimant la protéine X a été testée par comparaison des courbes de cinétique obtenues après l’injection de cellules exprimant la protéine X et de cellules témoins (cellules 293T transfectées par un plasmide vide) sur une biopuce modifiée par des anticorps anti-protéine X.
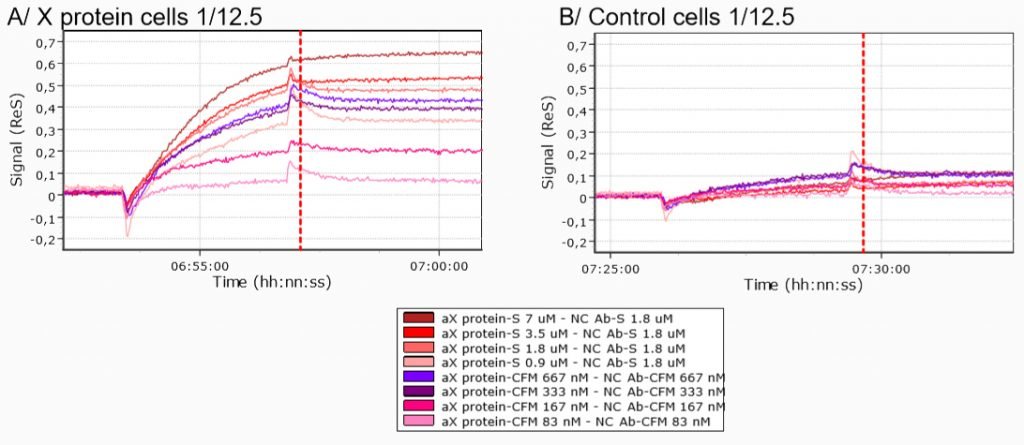
La comparaison des courbes de cinétique des cellules exprimant la protéine X à celles des cellules témoins révèle des différences claires de cinétique quelles que soient les conditions d’immobilisation.
Ces données indiquent donc que les cellules exprimant la protéine X se lient spécifiquement aux anticorps anti-protéine X.
ANALYSE CINÉTIQUE ET THERMODYNAMIQUE DE L’INTERACTION ANTICORPS-CELLULE
Des courbes de cinétique ont été produites par injection de cellules exprimant la protéine X sur la surface d’une biopuce modifiée par différentes concentrations d’anticorps anti-protéine X. La méthode de dépôt choisie est celle qui a donné les meilleurs résultats dans l’étude préliminaire décrite plus haut.
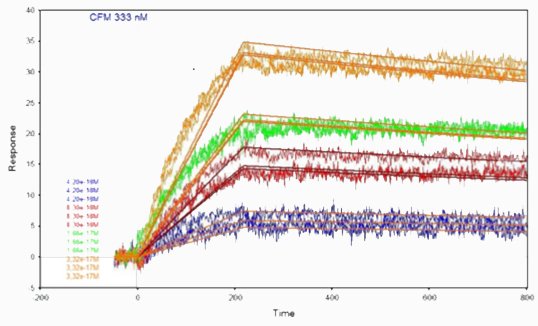
Les paramètres cinétiques ont été déterminés par ajustement des courbes aux différentes concentrations en utilisant un modèle d’interaction 1:1. La valeur du KD de l’anticorps a été obtenue par calcul du rapport kd/ka .
| Paramètres cinétiques et thermodynamiques | |||
|---|---|---|---|
| ka(M-1.s-1) | kd (s-1) | KD (M) | |
| Anti-protéine X / Cellules protéine X | 1,00×1010 | 2,46×10-4 | 2,46×10-14 |
CONCLUSION
La liaison spécifique des cellules exprimant la protéine X aux anticorps anti-protéine X a été démontrée par SPRi.
Les signaux de SPRi ont permis de mesurer un KD qui peut être interprété comme représentant une interaction anticorps-cellule avec une forte affinité. Cette affinité de liaison est principalement régie par une vitesse d’association élevée (ka). La configuration en multiplexage du SPRi a permis d’immobiliser les anticorps anti-protéine X sur la même biopuce avec deux méthodes d’immobilisation et quatre concentrations différentes pour chaque méthode. Lors de cette expérience, huit conditions expérimentales différentes ont été testées et 282 sensorgrammes différents ont été générés dans une seule biopuce.
Étude de cas 2 : Étude du KD d’anticorps par analyse Biacore
OBJECTIF DE L’ÉTUDE
Un client nous a demandé de mesurer les KD d’interactions anticorps-antigène par Biacore. Le but du projet était de classifier cinq anticorps différents selon leur affinité vis-à-vis du même antigène.
CONDITIONS EXPÉRIMENTALES
L’antigène a été immobilisé sur la surface de biopuces revêtue de dextran par chimie du maléimide classique pour former des liaisons thioéthers covalentes stables. Les solutions contenant les anticorps à différentes concentrations ont ensuite été versées sur l’antigène. La mesure du signal SPR aux différentes concentrations d’anticorps a permis de déterminer les paramètres cinétiques (on-rate ka, off-rate kd) et les paramètres thermodynamiques (KD).
MESURE DE L’AFFINITÉ DE L’ANTICORPS
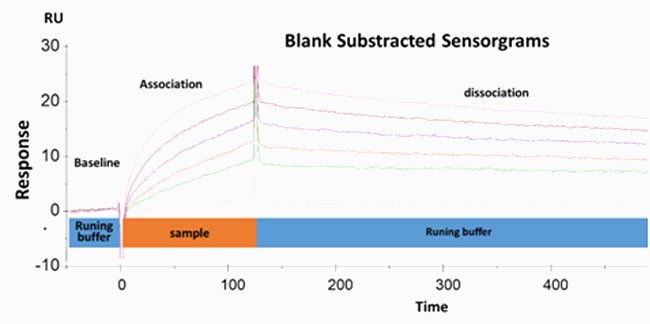
L’affinité de liaison anticorps/antigène peut être déduite du rapport kd/ka , ce qui permet de classer les anticorps selon leur affinité.
| Anticorps | ka (1/Ms) | kd (1/s) | KD (M) |
|---|---|---|---|
| A | 4,30×104 | 2,24×10-4 | 5,21×10-9 |
| B | 1,26×105 | 9,08×10-4 | 7,23×10-9 |
| C | 6,71×105 | 3,85×10-4 | 5,73×10-10 |
| 2,53×105 | 4,03×10-4 | 1,59×10-9 | |
| E | 2,36×105 | 7,97×10-4 | 3,72×10-9 |
Le classement des affinités des anticorps peut être déduit directement des valeurs des KD ; plus le KD est faible, plus l’affinité de l’anticorps est forte.
Classement des KD des anticorps: C<D<E<A<B
Classement des affinités des anticorps : C>D>E>A>B
CONCLUSION
L’analyse par Biacore a permis de conclure que les cinq anticorps testés possèdent une forte affinité vis-à-vis de l’antigène, l’anticorps C étant le meilleur pour plusieurs raisons :
- un KD plus faible révélateur d’une forte interaction,
- des paramètres cinétiques favorables (grande vitesse d’association et faible vitesse de dissociation).
