Sappiamo che l'umanizzazione degli anticorpi è una delle fasi più critiche nel percorso verso la produzione. Ecco perché i nostri esperti sono tra i ricercatori più autorevoli al mondo in questo campo e vantano un'eccezionale affidabilità. 3 anticorpi terapeutici sul mercato e oltre 30 in fasi precliniche e cliniche sono alcuni dei nostri risultati migliori. Riteniamo che ogni umanizzazione di anticorpi monoclonali sia una sfida unica ed appassionante per lo sviluppo del vostro composto fino alla fase clinica.
Perché scegliere ProteoGenix per
l'umanizzazione di anticorpi monoclonali?

Esperti di umanizzazione di anticorpi riconosciuti
Scegliete esperti con oltre 25 anni di esperienza e affidabilità ineguagliata nell’umanizzazione di anticorpi.

Modellamento 3D
La nostra piattaforma di modellamento molecolare 3D garantisce la conservazione delle funzioni biologiche.

Liberi da proprietà intellettuale
Proprietà completa degli anticorpi umanizzati.

Set di servizi di caratterizzazione completo
ELISA, determinazione della KD contro antigene o cellule solubili, termostabilità, velocità di aggregazione, IC50 ecc.

XtenCHOTM
Scegliete il sistema di espressione transitoria più produttivo per realizzare le vostre varianti di anticorpi umanizzati monoclonali.

Diversi formati
Ottimizziamo la sequenza o umanizziamo tutti i formati di anticorpo: IgG, scFv, Fab, VHH (nanobody) completi ecc.
Il nostro processo di umanizzazione di anticorpi monoclonali

- Sequenziamento dell’anticorpo a partire da linea cellulare di ibridomi
– Estrazione e purificazione dell’RNA
– Trascrizione inversa
– Amplificazione PCR
– Sequenziamento

- Valutazione della bioattività dell’anticorpo chimerico
– Sintesi genetica inclusa ottimizzazione dei codoni
– Subclonaggio in un vettore di espressione
– Produzione e purificazione dell’anticorpo chimerico
– Analisi QC
Go/No Go1

- Progettazione dell’anticorpo monoclonale umanizzato
– Identificazione di retromutazioni mediante modellamento molecolare 3D
– Selezione delle linee germinali umane più appropriate
– Sostituzione delle CDR in silico e ottimizzazione della sequenza
Go/No Go2

- Produzione dell’anticorpo umanizzato (da 9 a 18 varianti)
– Sintesi genetica inclusa ottimizzazione dei codoni
– Subclonaggio in un vettore di espressione
– Transfezione, espressione e purificazione transitoria
– Analisi QC
Go/No Go3

- Caratterizzazione delle varianti umanizzate
– ELISA contro antigene
– Affinità dell’anticorpo contro antigene o cellula solubile
– Velocità di aggregazione
– Termostabilità
– Profilo di glicosilazione
– Rilevazione di endotossine
Contenuto del nostro servizio di umanizzazione di anticorpi monoclonali
| Fase | Contenuto | Tempistica | Prodotti forniti |
|---|---|---|---|
| Sequenziamento di anticorpi parentali da ibridomi |
|
~2-3 settimane |
|
| Espressione e purificazione dell’anticorpo chimerico |
|
~7-9 settimane |
|
| Progettazione dell’anticorpo umanizzato |
|
~2 settimane |
|
| Produzione ricombinante transitoria di 9-18 varianti di anticorpo umanizzato |
|
~7-9 settimane |
|
| Caratterizzazione di varianti dell’anticorpo monoclonale umanizzato |
|
Da stabilire |
|
Opzioni disponibili:
|
|||
Quali fattori devono essere considerati per l'umanizzazione di anticorpi monoclonali?
L’obiettivo principale del processo di umanizzazione di anticorpi è sviluppare una sequenza dell’anticorpo conforme alle linee guida dell’Organizzazione Mondiale della Sanità (WHO) per gli anticorpi umanizzati. In sostanza un anticorpo è considerato umanizzato quando sequenza dell’anticorpo e sequenza della linea germinale umana (da database IMGT) sono identici almeno all’85%. La differenza tra anticorpo umanizzato e anticorpo totalmente umano dipende dall’origine dell’anticorpo. Gli anticorpi derivanti da specie non umane dopo l’umanizzazione verranno classificati come “umanizzati”, mentre sequenze derivate da soggetti umani saranno considerate “anticorpi totalmente umani”.
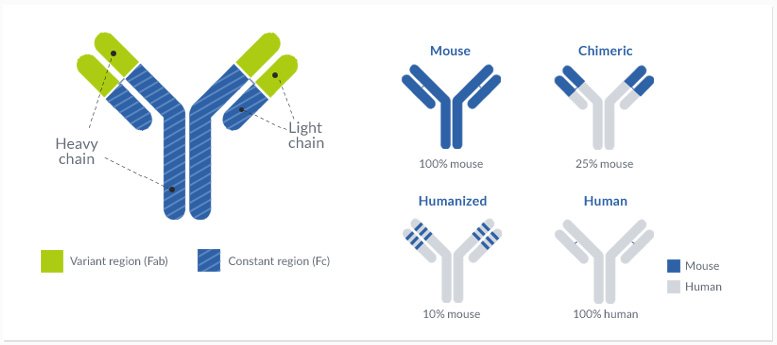
Raggiungere l’obiettivo dell’85% comporta la modifica della sequenza dell’anticorpo nelle regioni variabili. Questa operazione di ingegnerizzazione dell’anticorpo può avere un impatto critico sulle proprietà fisico-chimiche e farmacologiche del prodotto finale, e deve essere quindi eseguita con attenzione. A tale scopo, ProteoGenix offre know-how ineguagliato nell’ingegnerizzazione di anticorpi, esperti con oltre 25 anni di esperienza e un’ affidabilità senza paragoni nell’umanizzazione di anticorpi. Il nostro processo di umanizzazione comprende sostituzione della CDR, modellamento molecolare e ottimizzazione della sequenza.
Il modellamento molecolare è una parte importante del processo perché consente di analizzare i contributi di singoli aminoacidi localizzati negli anelli di CDR e nelle regioni framework. Questa fase è fondamentale per identificare i residui adatti a retromutazioni e quelli che possono essere mutati per un’ulteriore ottimizzazione delle proprietà. Gli aminoacidi coinvolti nelle regioni variabili possono essere classificati come segue:
-
Residui coinvolti nell’interazione anticorpo-antigene.
-
Residui con ruolo strutturale, ad esempio mantenimento della conformazione dell’anello di CDR o stabilizzazione dell’interazione VH-VL .
-
Residui interagenti con il solvente.
I residui delle regioni framework murine considerati critici per il mantenimento della conformazione degli anelli di CDR e della bioattività dell’anticorpo verranno retromutati nelle linee germinali umane selezionate.
La selezione della linea germinale umane si basa sull’omologia di sequenza, tuttavia è possibile testare altre varianti umanizzate che mostrano un’omologia di sequenza inferiore ma con buone proprietà fisico-chimiche. Nei progetti di umanizzazione ProteoGenix seleziona diverse catene pesanti e leggere per generare da 9 a 18 combinazioni.
I diversi anticorpi generati sono ulteriormente caratterizzati e confrontati con l’anticorpo di riferimento parentale e/o chimerico per valutarne:
-
Immunogenicità
-
Proprietà fisico chimiche (stabilità, velocità di aggregazione ecc.)
-
Proprietà farmacologiche (affinità, specificità ecc.)
-
Producibilità
Dopo avere superato i test, i candidati lead possono essere selezionati per un’ulteriore umanizzazione e/o l’ottimizzazione della sequenza delle CDR per migliorare proprietà biofisiche (eterogeneità, frammentazione, aggregazione ecc.) e producibilità (bioproduzione).
I servizi di maturazione dell’affinità dell’anticorpo completi possono essere realizzati mediante phage display con librerie personalizzate generate da mutagenesi casuale o del target.





