Grazie all’esclusiva piattaforma per la determinazione della KD, ProteoGenix è lo STANDARD di riferimento nella misurazione dell’affinità dell’anticorpo. Con le nostre 3 tecnologie oggi è possibile misurare le interazioni con cellule, batteri, proteine in conformazione nativa o eseguire la determinazione della KD ad alta produttività. Inviateci i vostri requisiti e i nostri account manager con dottorato di ricerca vi indicheranno la soluzione migliore per soddisfare le vostre aspettative di accuratezza, prezzo e tempistica.
Perché scegliere ProteoGenix per lo
Determinazione della KD dell'anticorpo?

Prezzo competitivo
Garantiamo il prezzo più basso sul mercato.

3 tecnologie diverse e complementari
Misurazione dell’affinità dell’anticorpo con SPR, SPRi o Octet.

Servizio di misurazione dell'affinità anticorpo-cellula esclusivo
Compatibile anche con la determinazione della KD ad alta produttività.

Attrezzature all'avanguardia
Siamo tra i pochi fornitori di servizi che offrono determinazione della KDdell’anticorpo con SPRi.

Misurazione label-free
Nessun ritardo sulla consegna né costi extra, artefatti o bias (sito di legame occluso, interazione idrofobica falsa).

Account manager con dottorato di ricerca
Avete bisogno di consulenza per scegliere la tecnologia giusta? I nostri account manager scientifici vi aiutano a scegliere la tecnologia più appropriata.

Consegna rapida
Valori della KD dell’anticorpo in 2/3 settimane.
Un servizio di misurazione dell'affinità dell'anticorpo su misura per le vostre esigenze!
Con oltre 300 anticorpi monoclonali già sviluppati e caratterizzati per vari clienti, ProteoGenix ha acquisito una grande competenza nell’analisi delle interazioni biomolecolari. Siamo in grado di offrirvi la migliore soluzione per i vostri requisiti, sia per la determinazione della KD ad alta produttività che per l’analisi di campioni grezzi (cellule, batteri ecc.).
|
|
 SPR / GE Biacore X100 – T200 – 8K
|
 SPRi / Horiba XelPlex
|
 Octet / ForteBio Octet Red
|
|---|---|---|---|
| Applicazione | “Gold standard” Determinazione della KD ad alta produttività Interazione anticorpo-antigene Analisi dell’interazione biomolecolare |
Determinazione della KD ad alta produttività Analisi dell’interazione anticorpo-cellula Analisi dell’interazione biomolecolare |
Determinazione della KD ad alta produttività Analisi dell’interazione biomolecolare |
| Tecnologia | Risonanza plasmonica di superficie (SPR) | Imaging di risonanza plasmonica di superficie (SPRi) | Interferometria |
| Principio di misurazione | Modifica dell’indice di rifrazione | Modifica dell’indice di rifrazione | Traslazione della lunghezza d’onda |
| Label-free | Sì | ||
| Analisi di campioni grezzi (cellule, batteri ecc.) | No | Sì | Sì |
| Possibilità di rivestire le proteine (oltre agli anticorpi) mantenendo la conformazione nativa | No | Sì | No |
| Imaging | No | Sì | No |
| Multiplex | ++ | ++++ | ++ |
| Limite di rilevazione | +++ | +++ | + |
| Complessità della tecnologia | + | +++ | ++ |
| Costo/anticorpo | + | +++ | ++ |
| Tempo di consegna | 2/3 settimane | ||
Avete dubbi sulla tecnica per la determinazione della KD dell’anticorpo più adatta per il vostro studio?
Inviate i vostri requisiti al nostro account manager con dottorato di ricerca.
Caso di studio 1: determinazione della KD dell'anticorpo tra un anticorpo anti-proteina X e una proteina X espressa sulla superficie di cellule 293T con tecnologia SPRi (Horiba XelPlex)
SCOPO DELLO STUDIO
Il cliente ha richiesto la misurazione dell’affinità di legame dell’anticorpo anti-proteina X contro una proteina X transmembrana espressa sulla superficie di cellule 293T. L’espressione e la presentazione della proteina direttamente nella cellula ci ha consentito di presentare l’epitopo extracellulare mantenendone la conformazione nativa.
Le misurazioni sono state eseguite usando la tecnologia di imaging di risonanza plasmonica di superficie (Horiba XelPlex).
FUNZIONALIZZAZIONE DI BIOCHIP
Il biochip è stato modificato utilizzando una strategia di accoppiamento delle ammine tradizionale. In breve, una superficie -COOH terminale è stata attivata mediante EDC/NHS determinando un estere solfo-NHS reattivo. È noto che questo prodotto intermedio reagisce con le ammine primarie formando un legame ammidico stabile.
Sono stati inoltre testati 2 metodi di deposizione dell’anticorpo anti-X per determinare l’approccio di spotting ottimale (dettagli forniti nel file PDF).
STUDIO DELLA SPECIFICITÀ DELL’INTERAZIONE ANTICORPO-CELLULA
Il legame specifico per le cellule della proteina X è stato testato confrontando le curve cinetiche ottenute iniettando cellule di proteina X e cellule di controllo (cellule 293T transfettate mediante plasmide vuoto) su un biochip modificato dell’anticorpo anti-proteina X.
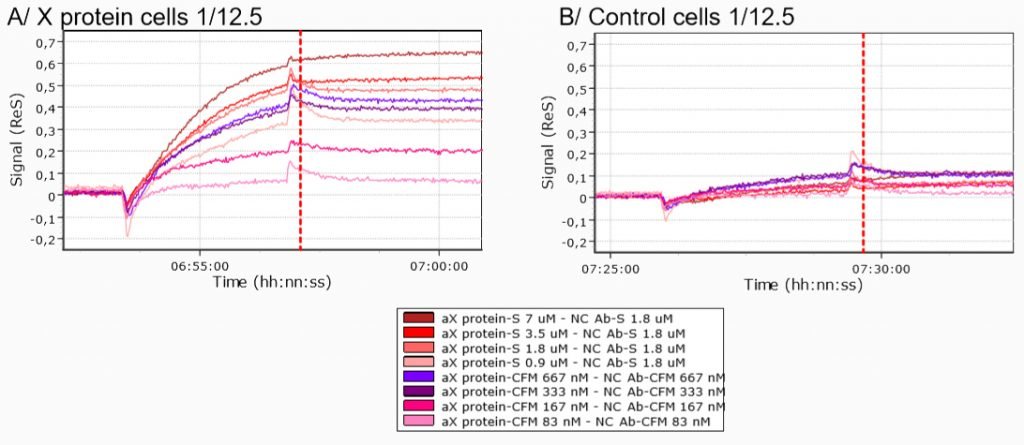
Il confronto tra le iniezioni di cellule di proteina X e cellule di controllo sul biochip modificato dell’anticorpo anti-proteina X ha evidenziato chiare differenze tra le curve cinetiche, indipendentemente dalle condizioni di immobilizzazione.
Pertanto, i dati ottenuti dimostrano che le cellule della proteina X si legano in modo specifico all’anticorpo anti-proteina X.
ANALISI CINETICA E TERMODINAMICA DELL’INTERAZIONE ANTICORPO-CELLULA
Le curve cinetiche sono state ottenute iniettando cellule di proteina X sulla superficie modificata dell’anticorpo anti-proteina X a diverse concentrazioni. Il metodo di deposizione scelto è quello che ha dato i migliori risultati nel primo studio sopra indicato.
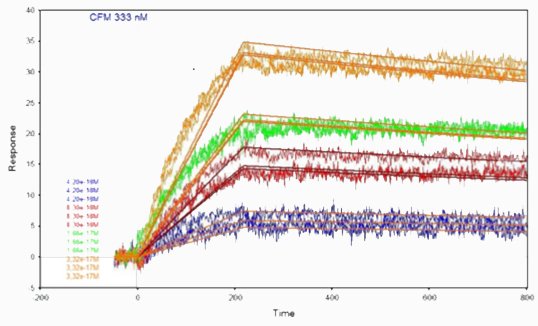
I parametri cinetici sono stati determinati adattando le curve a diverse concentrazioni utilizzando un modello di interazione 1:1. Il valore KD è stato ottenuto calcolando il rapporto kd/ka .
| Parametri cinetici e termodinamici | |||
|---|---|---|---|
| ka(M-1.s-1) | kd (s-1) | KD (M) | |
| Proteina anti-X/cellule proteina X | 1,00,1010 | 2,46,10-4 | 2,46,10-14 |
CONCLUSIONE
Il legame specifico delle cellule della proteina X all’anticorpo anti-proteina X è stato dimostrato mediante il metodo SPRi.
I segnali SPRi hanno consentito di misurare un valore apparente di KD basso, che può essere interpretato come un’interazione anticorpo-cellula ad alta affinità. Questa affinità di legame dipende principalmente da un’alta velocità di associazione (ka). La configurazione multiplex del metodo SPRi ha permesso di immobilizzare l’anticorpo anti-proteina X sullo stesso biochip con due metodi di immobilizzazione differenti e in quattro diverse concentrazioni per ogni metodo. Durante l’esperimento sono state testate 8 condizioni sperimentali e generati 282 sensorgrammi diversi su un unico biochip.
Caso di studio 2: studio di KD dell'anticorpo con analisi Biacore
SCOPO DELLO STUDIO
Un cliente ha richiesto la misurazione del valore KD di un’interazione anticorpo/antigene mediante analisi Biacore. Il progetto riguardava il livello di affinità di 5 diversi anticorpi contro lo stesso antigene.
CONFIGURAZIONE SPERIMENTALE
L’antigene è stato immobilizzato sulla superficie del biochip rivestito in destrano tramite reazione con maleimide, che ha determinato un legame tioetere covalente stabile. Le soluzioni contenenti gli anticorpi in diverse concentrazioni sono state quindi applicate sull’antigene. La misurazione del segnale SPR a diverse concentrazioni di anticorpo ha consentito di determinare i parametri cinetici (k on-ratea, k off-rated) e i parametri termodinamici (KD).
MISURAZIONE DELL'AFFINITÀ DELL'ANTICORPO
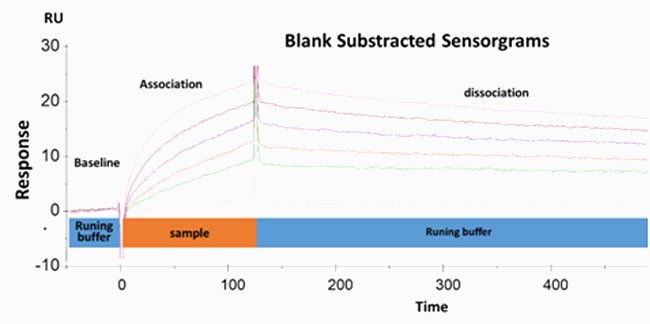
L’affinità del legame anticorpo/antigene può essere dedotta dal rapporto kd/ka , che consente di definire il livello di affinità.
| Anticorpo | ka (1/Ms) | kd (1/s) | KD (M) |
|---|---|---|---|
| A | 4,30×104 | 2,24×10-4 | 5,21×10-9 |
| B | 1,26×105 | 9,08×10-4 | 7,23×10-9 |
| C | 6,71×105 | 3,85×10-4 | 5,73×10-10 |
| D | 2,53×105 | 4,03×10-4 | 1,59×10-9 |
| E | 2,36×105 | 7,97×10-4 | 3,72×10-9 |
Il livello di affinità dell’anticorpo può essere dedotto direttamente dal valore KD dell’anticorpo, perché minore è il valore KD , maggiore è l’affinità dell’anticorpo.
Livello KD anticorpo: C>D>E>A>B
Livello affinità anticorpo: C>D>E>A>B
CONCLUSIONE
L’analisi Biacore ha evidenziato che tutti i 5 anticorpi testati dimostrano un’elevata affinità contro l’antigene e che l’anticorpo C è il migliore per diversi motivi:
- KD inferiore, valore indicativo di una forte interazione.
- Parametri cinetici favorevoli (velocità di associazione maggiore e bassa velocità di dissociazione).
